近日,我校未来光学国际实验室张大伟教授课题组研发了一种两个器官联动的微流控芯片,可以精确调控每个腔室的氧气浓度,并通过芯片上的传感器监测氧浓度水平,在上游仿肿瘤器官的肿瘤细胞培养腔室实现缺氧环境,下游模仿正常器官的细胞培养腔室实现常氧环境,通过管道将不同氧浓度的腔室联通,模拟真实肿瘤病人人体生理内环境,并在芯片上实现缺氧环境诱导的肿瘤器官转移和快速药物筛选。该论文成果题为《用于研究缺氧诱导肺癌肝转移和药物筛选的氧浓度可控的多器官微流控平台》(An oxygen concentration-controllable multi-organ microfluidic platform for studying hypoxia-induced lung cancer-liver metastasis and screening drug),发表于美国化学会分析传感顶级期刊ACS Sensors(2020最新IF=7.33,中科院升级版大类化学一区,小类分析化学一区),郑璐璐副教授、王波同学为第一作者。该器官芯片提供稳定的接近人体生理的微环境,适用于体外模拟肿瘤转移过程,并有望结合类器官模型,为类器官生长提供接近人体生理环境的培养条件,为疾病尤其是肿瘤转移的建模、快速药物筛选开辟令人振奋的前景。
药物在上市前的临床实验过程中,传统主要依赖动物模型完成大量的毒性、动力学及药效评价。由于动物模型存在种属差异性、伦理问题及冗长的实验周期等问题,建立一种快速、高通量、自动化以及规避种属差异的新型药物筛选平台已经成为目前全球药物研发的燃眉之急。近来,人们逐渐意识到了器官芯片尤其是整合多个器官的模仿人体代谢途径的多器官芯片,能够补充动物实验对于医学研究的价值:从基础生物学研究到药物开发和测试,多器官芯片通过模拟人体微环境,结合细胞培养技术通过培养健康或患病的人体细胞或组织来补充动物实验,验证药效和毒性,从而缩短临床试验的漫长周期。
缺氧微环境广泛存在于实体肿瘤中,是肿瘤增殖、侵袭和转移的主要诱因之一,还能使癌细胞对许多传统抗癌药物产生抗药性。因此,缺氧是肿瘤微环境的重要特征,通过多器官芯片实现肿瘤微环境的缺氧精准模拟非常重要。
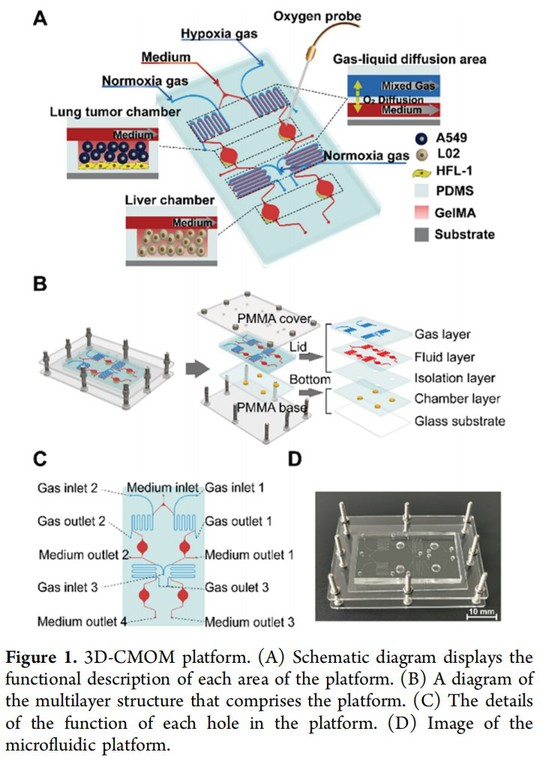
人工器官微流控模拟芯片结构图
【相关】
论文链接:https://pubmed.ncbi.nlm.nih.gov/33657793/
英文网相关报道链接:
https://en.usst.edu.cn/info/1023/2233.htm
供稿:光电学院










